Kostenlos: der ÄFI-Newsletter
Bleiben Sie auf dem Laufenden beim Thema
Impfungen & Impfentscheidung und rund um den Verein.
Rotaviren (Gastroenteritis)
Welche Krankheit kann durch Rotaviren hervorgerufen werden und wie gefährlich ist diese? Welche präventiven-, welche Risikofaktoren gibt es? Wie viele rotavirusbedingte Todesfälle gibt es jährlich in Deutschland? Welche Rotavirus-Impfstoffe gibt es und welchem primären Ziel dienen diese? Was sind Darminvaginationen und wieso führte diese Nebenwirkung der Impfstoffe 2015 in Frankreich zur Rücknahme der Impfempfehlung? Antworten auf diese und weitere Fragen finden Sie im nachfolgenden Fachbeitrag.
Vorbemerkung
Die folgenden Ausführungen dienen der Information und ersetzen keinesfalls das ärztliche Beratungsgespräch. Hier werden Fakten präsentiert, die Eltern wie auch Ärztinnen und Ärzten in einem Aufklärungsgespräch helfen können. Ärztinnen und Ärzte für individuelle Impfentscheidung e. V. (ÄFI) übernimmt keine Garantie für Vollständigkeit, hat die hier verfügbaren Inhalte jedoch nach bestem Wissen und Gewissen am aktuellen Fach- und Sachstand zusammengetragen. Über die wissenschaftliche Arbeit des Vereins erfahren Sie hier mehr. Der Fachbeitrag wird jährlich aktualisiert. Das dargelegte Wissen entspricht dem Kenntnisstand zum angegebenen Veröffentlichungs- bzw. Aktualisierungsdatum. Weitere Informationen erhalten Sie auch in unserem Podcast.
Im Podcast anhören
Fachbeitrag
- Rotaviren: Die Erkrankung
Erreger
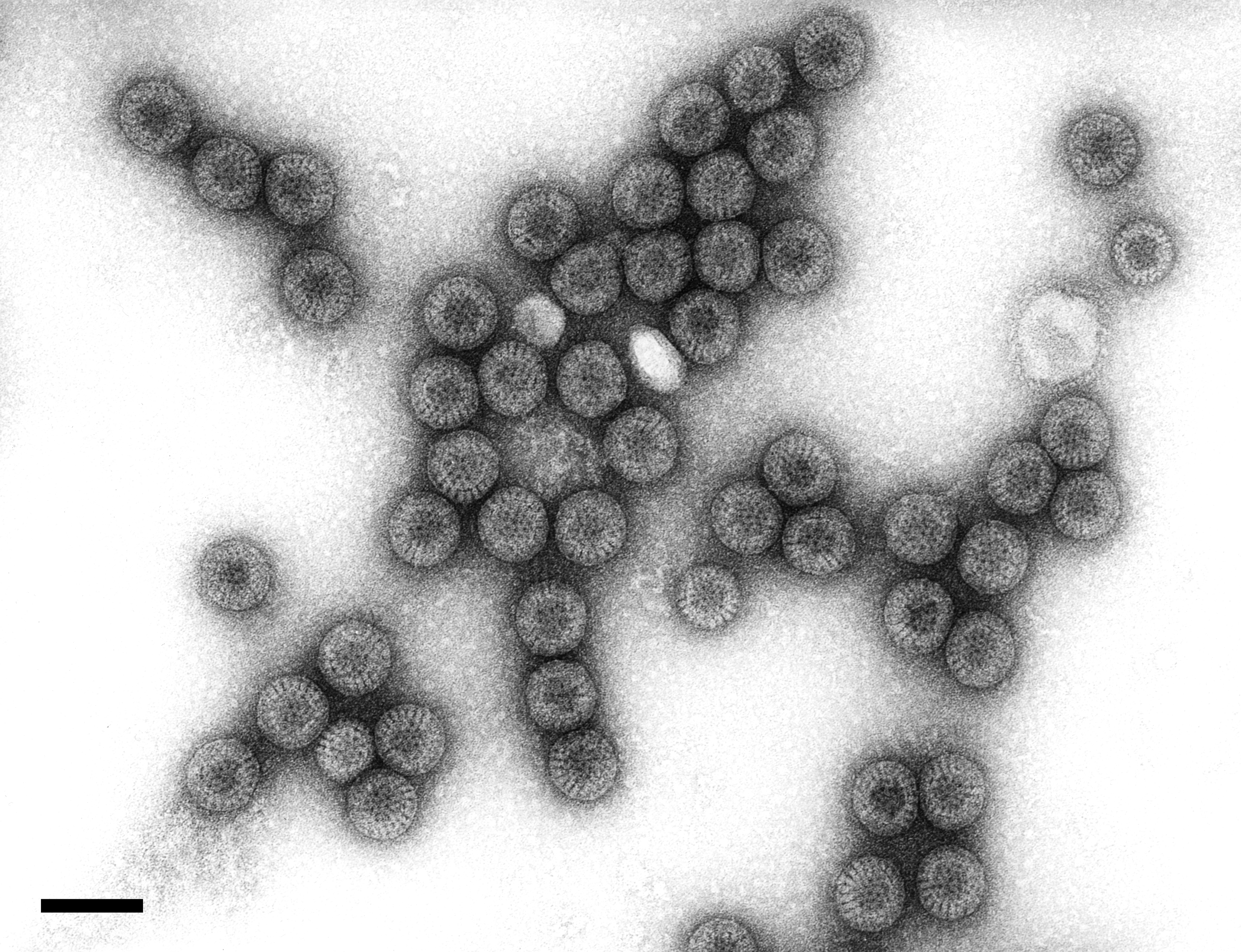
- Rotaviren sind unbehüllte, doppelsträngige RNA-Viren mit einem „radförmigen“ Erscheinungsbild (s. Abbildung 1) und einem Durchmesser von etwa 75 nm, die zur Familie der Reoviridae gehören (Robert Koch-Institut, 2010; LeClair & McConnell, 2024).
- Die Viren sind seit den 1960er Jahren bekannt, wurden aber erstmals 1973 anhand von Zwölffingerdarm-Biopsien im Menschen entdeckt (Dennehy, 2008).
- Es werden 7 Serogruppen unterschieden (A, B, C, D, E, F & G), wobei epidemiologisch Serogruppe A am wichtigsten ist. Die Serogruppen B und C machen einen weiteren, aber sehr kleinen Anteil an den Infektionen aus. Weiterhin gibt es innerhalb der Serogruppe A verschiedene Serotypen bzw. Stämme, von denen G1P[8] und G4P[8], gefolgt von G2P[4] und G9P[8] am relevantesten sind (Robert Koch-Institut, 2010; LeClair & McConnell, 2024).
- Rotaviren sind sehr umweltresistent und überleben damit sehr lange auf Oberflächen (Robert Koch-Institut, 2010).
- Für Rotaviren besteht seit Inkrafttreten des Infektionsschutzgesetzes (IfSG) im Jahr 2001 eine Meldepflicht (Robert Koch-Institut, 2010).
- Der Mensch bildet das Hauptreservoir für Rotaviren. Rotaviren, die bei Haus- und Nutztieren gefunden wurden, sind wahrscheinlich kaum von Bedeutung für den Menschen (Robert Koch-Institut, 2010).
Abbildung 1: Humanes Rotavirus (Rotaviren). Transmissions-Elektronenmikroskopie, Negativkontrastierung. Maßstab = 100 nm (Robert Koch-Institut, 2014).
Infektionsmodus
Besiedlung:
- In einer älteren französischen Studie (vor Zulassung der Impfung) mit 179 (wegen verschiedenen Erkrankungen) hospitalisierten Kindern im Alter von 0 bis 24 Monaten, deren Titer gemessen wurden, konnte festgestellt werden, dass etwa 20 % der Kinder eine symptomatische Erkrankung durchgemacht haben, etwa 10 % asymptomatisch infiziert waren, 20 % Virusträger waren und die restlichen 50 % sich nicht infiziert haben (Champsaur et al., 1984).
- In einer neueren nigerianischen Studie mit Stuhlproben von 269 gesunden Kindern unter 15 Jahren konnte bei 19,9 % ein positives Ergebnis auf Rotaviren festgestellt werden. Nigeria hat wie andere afrikanische Staaten bisher die Rotavirus-Impfung noch nicht in das nationale Immunisierungsprogramm aufgenommen (Akinola et al., 2020).
- Es gibt noch weitere Studien zur Häufigkeit von asymptomatischen Rotavirus-Infektionen, deren Ergebnisse sich (auch durch den Impfstatus und das Alter) stark unterscheiden. Die Spanne reicht dabei von 7,2 % bis 44,4 % bei Kindern und Säuglingen, wobei jüngere Kinder grundsätzlich häufiger infiziert sind (Barrón-Romero et al., 1985; Aminu et al., 2008; Ramani et al., 2008; Simwaka et al., 2018).
- Erwachsene sind eher seltener mit Rotaviren infiziert. Eine englische Studie vor Einführung der Rotavirus-Impfung in das nationale Immunisierungsprogramm für Säuglinge im Jahr 2013 kommt auf eine generelle Häufigkeit von 11 % in der Bevölkerung. Es werden aber auch Häufigkeiten von bis zu 1/3 aller Erwachsenen berichtet (Amar et al., 2007; Phillips et al., 2010).
Transmission & Inkubation:
- Die Übertragung erfolgt primär fäkal-oral, aber auch durch Schmierinfektionen sowie durch kontaminiertes Wasser und Lebensmittel (Dennehy, 2000; Robert Koch-Institut, 2010).
- Auf Händen überleben Rotaviren mindestens 4 Stunden, auf Umgebungsoberflächen Tage bis Wochen, in Trinkwasser und Freizeitgewässern sogar mehrere Wochen (Dennehy, 2000).
- Durch Rotaviren infizierte Kinder scheiden 100 Milliarden (100 x 109) Viruspartikel pro Gramm Stuhl aus (Flewett, 1983). Untersuchungen am Menschen mit sicherheitsgeprüften Stämmen zeigen, dass die Aufnahme von nur 10 infektiösen Viruspartikeln (9 x 10-3 bis 9 x 104 FFU/ml) ausreichen kann, um den Wirt zu infizieren (Ward et al., 1986).
- In Gemeinschaftseinrichtungen scheint auch der Luftweg eine Rolle bei der Übertragung zu spielen – es ist jedoch nicht geklärt, ob „kleinere“ Aerosole oder „größere“ Tröpfchen dabei ausschlaggebend sind (Dennehy et al., 1998; Dennehy, 2000).
- Die Saisonalität wird als Faktor für die vermehrte Übertragung aufgefasst. Bei kaltem und trockenem Wetter im Vergleich zu warmem und feuchtem Wetter werden nicht nur mehr Kinder infiziert, sondern auch mehr Hospitalisierungen erfasst (Brandt et al., 1982; Akinola et al., 2020).
- Die infektiöse Phase beträgt etwa 1 bis 3 Wochen (European Centre for Disease Prevention and Control, 2023).
- Die Inkubationszeit ist mit 1 bis 3 Tagen recht kurz. Schon vor dem Auftreten erster Symptome sind Kinder in etwa der Hälfte der Fälle infektiös (Dennehy, 2000).
Infektionsverlauf
- Eine symptomatische Rotavirus-Infektion gleicht Magen-Darm-Erkrankungen (Gastroenteritis), die durch andere Erreger (Noroviren, enterische Adenoviren, Astroviren, Escherichia coli und Salmonellen) hervorgerufen werden – klinisch lässt es sich also nicht unterscheiden. Rotaviren-Gastroenteritiden verlaufen jedoch bei Säuglingen und Kleinkindern meist schwerer (Dennehy, 2000; Robert Koch-Institut, 2010; LeClair & McConnell, 2024).
- Bei einer Ersterkrankung kommt es nach klinischer Erfahrung der ÄFI zu einem zweigipfligen Verlauf, wobei die Symptomatik nach einem Tag der Besserung erneut mit Erbrechen und Durchfall für einen kürzeren Zeitraum zurückkehrt. Die häufigsten Symptome sind Fieber, Durchfall und Erbrechen, die jeweils einzeln oder kombiniert auftreten können (Dennehy, 2000).
Abbildung 2: Erkennung von Rotaviren bei 234 stationär aufgenommenen Kindern anhand vorliegender Symptome. Abbildung in Anlehnung an (Bernstein, 2009).
- Bei den selteneren symptomatischen Rotavirus-Erkrankungen im Erwachsenenalter (dies gilt insbesondere auch für Reisende und immungeschwächte Personen) kommt es zu Übelkeit, Unwohlsein, Kopfschmerzen, Bauchkrämpfe, Durchfall und Fieber (Anderson & Weber, 2004).
- Die Dauer der Erkrankung beträgt durchschnittlich 2 bis 6 Tage.
Mögliche Komplikationen
- Aufgrund von Durchfall und Erbrechen kann es zu einer raschen Dehydration mit Schock, Elektrolytstörung und – falls nicht, zu spät oder falsch behandelt – dadurch auch zum Tod kommen (Crawford et al., 2017).
- In sehr wenigen Fällen sind auch systemische Auswirkungen bekannt, wie z. B. Meningitis, Enzephalitis, Enzephalopathie und Krampfanfällen, die ebenfalls tödlich verlaufen können. Die Mechanismen für die extra-intestinale Infektion sind jedoch nach wie vor unklar (Crawford et al., 2017).
- Im Rahmen der Hyperperistaltik bei dieser Durchfallerkrankung kann es sehr selten zu einer Invagination des Darmes kommen, die sich in Bauchkrämpfen bemerkbar macht und einen typischen himbeergelee-artigen Stuhl als Zeichen der Darmblutung provoziert. Daten über Rotavirus-Gastroenteritiden-bedingte Darminvaginationen sind jedoch sehr limitiert – in den meisten Fällen sind Adenoviren-Gastroenteritiden für die Entwicklung einer Darminvagination verantwortlich (Willame et al., 2021).
- Folgeschäden sind eine absolute Ausnahmeerscheinung bei Rotavirus-Gastroenteriden (arznei-telegramm, 2013).
Pathogenese
- Nach Eintritt über den Mund wandern Rotaviren über den Gastrointestinaltrakt zum Dünndarm und infizieren dort reife intestinale Enterozyten in den Dünndarmzotten (Estes et al., 2001; Lundgren & Svensson, 2001).
- Dies kann dazu führen, dass Nährstoffe wie Natrium, Glukose und Wasser schlechter aufgenommen werden, außerdem kann die Laktase-, Phosphatase- und Sucraseaktivität verringert sein (Centers for Disease Control and Prevention, 2021).
- Die 6 Nichtstrukturproteine (NSP1, NSP2, NSP3, NSP4, NSP6, NSP7) sind für die Genomreplikation und die Bekämpfung der angeborenen Immunantwort für Rotaviren wichtig. Insbesondere NSP4 gilt als Enterotoxin und führt zu einer übermäßigen Freisetzung von Serotonin (5-HT), wodurch vagale Nerven aktiviert werden, die mit Übelkeit und Erbrechen in Verbindung stehen (Crawford et al., 2017).
- Die Entzündungsreaktion ist im Vergleich zu durch bakterielle Erreger ausgelöste Gastroenteritiden gering: Das C-reaktive Protein und das fäkale Calprotectin sind bei einer rotavirusbedingten Gastroenteritis nahezu unverändert. Deswegen wird von einer nicht entzündlichen Diarrhoe ausgegangen (Crawford et al., 2017).
- Verschiedene Zytokine, darunter IL-18, IL-22 und IFN85 sollen an der Beseitigung von Rotaviren aus dem Organismus beteiligt sein – die Daten dazu sind bisher aber begrenzt (Crawford et al., 2017).
Prävention
Als präventive Faktoren gelten …
- … maternale Antikörper, weshalb Rotavirus-Erkrankungen erst ab 4 Lebensmonaten und bis 23 Monaten ihren Höhepunkt erreichen (Crawford et al., 2017).
- … Stillen, insbesondere während der ersten 6 Lebensmonate, wie ein systematisches Review ergibt (Krawczyk et al., 2016).
- … bereits durchgemachte Rotavirus-Infektionen, die zwar nicht vor Reinfektionen schützen, aber mit jeder weiteren Infektion einen immer besseren Schutz vor einem klinisch schweren Verlauf bieten. In einer mexikanischen Kohortenstudie wurde entdeckt, dass nach einer einzigen Infektion mit Rotaviren 38 % der Kinder gegen alle weiteren Infektionen geschützt waren, 77 % waren gegen rotavirusbedingten Durchfall geschützt und 87 % gegen schweren Durchfall (Bishop et al., 1983; Centers for Disease Control and Prevention, 2021).
- … Handhygiene, wenn sie von allen sorgfältig durchgeführt werden, die Kontakt zu Betroffenen haben (European Centre for Disease Prevention and Control, 2023).
Maßnahmen bei einer Erkrankung:
- Erkrankte Personen sollen abgesondert/isoliert werden.
- Hygienemaßnahmen sollen ausgeweitet werden: Zur Vermeidung einer Infektion sind Handschuhe und Schutzkittel geboten, Handhygiene und Desinfektion (von Händen, aber auch von Kontaktflächen wie z. B. Türgriffe) sind unbedingt notwendig.
- § 34 Abs. 1 IfSG verbietet erkrankten Kindern unter 6 Jahren den Besuch einer Gemeinschaftseinrichtung. 48 Stunden nach Verschwinden der Symptome können diese dann wieder zugelassen werden (eine Absicherung durch ein ärztliches Urteil, das auch mündlich erfolgen kann, kann sinnvoll sein, ist aber nicht zwingend notwendig). Gleiches gilt für Personen in Lebensmittelberufen zur Ausübung ihrer Arbeit.
- Bei einem Ausbruch in Krankenhäusern, Gemeinschaftseinrichtungen oder Altenheimen ist eine klinische Abgrenzung zu anderen Erregern (z. B. Lebensmitteltoxine) wichtig. Auch ohne labordiagnostische Bestätigungen sollten dann bereits Maßnahmen ergriffen werden.
(Robert Koch-Institut, 2010)
Prognose
- Rotavirus-Infektionen verlaufen meist nicht tödlich, da sie sich in der Regel auf den Magen-Darm-Trakt beschränken und erfolgreich behandelbar sind. Die Prognose ist somit insgesamt gut (LeClair & McConnell, 2024).
- Bei Kindern mit Vorerkrankungen (wie z. B. Schädigungen des zentralen Nervensystems) ist die Prognose dagegen weniger gut (Zhou et al., 2015).
- Die Fallsterblichkeit für Rotaviren ist mit 0,1 % (random-effects model) bzw. 0,63 % (fixed-effects model) laut einem systematischen Review mit Meta-Analyse deutlich geringer als für andere Erreger von Durchfallerkrankungen (0,4 bzw. 6,54 %). Viele der ausgewerteten Studien (46 %) wiesen eine sehr niedrige länderspezifische Sterblichkeitsrate unter 5 Jahren (U5MR) auf und die allermeisten Studien (86 %) beinhalteten keinen einzigen Todesfall durch Rotaviren (Asare et al., 2022).
- In Entwicklungsländern liegt die Fallsterblichkeit laut WHO mit 2,5 % wesentlich höher (World Health Organization, 2018).
- Für die Europäische Union (EU) wird die Mortalitätsrate in zwei Studien mit unter 0,1 bzw. unter 0,2 pro 100.000 Einwohner berechnet (European Centre for Disease Prevention and Control, 2017).
Abbildung 3: Rotavirus-Todesrate bei Kindern unter fünf Jahren im Jahr 2016 (Our World in Data, 2018).
Risikofaktoren für eine Infektion:
- Alter (v. a. Kinder im Alter von 4 bis 23 Monate)
- Frühgeburtlichkeit und geringes Geburtsgewicht (unter 2.500 g)
- Weitere Kinder unter 24 Monaten im Haushalt
(Crawford et al., 2017; European Centre for Disease Prevention and Control, 2017; Marcinek et al., 2023)
Risikofaktoren für einen Ausbruch:
- Stadtteile mit hoher Arbeitslosigkeit
- Besuch von Gemeinschaftseinrichtungen
- Saisonalität (Wintermonate in gemäßigten Klimazonen)
(Anderson & Weber, 2004; Binka et al., 2003; Wilking et al., 2012)
Therapie
- Als Faustregel gilt: Dauert die Erkrankung des Kindes länger als eine Woche an, erbricht es sich häufiger als 2 Mal pro 12 Stunden, ist wässriger Stuhl und/oder mäßiges Fieber vorhanden oder “verfällt” der Patient im Allgemeinzustand zusehends, sollte ein Arzt aufgesucht werden. Andernfalls kann der Patient vorerst beobachtet werden.
- Zunehmendes und/oder starkes Erbrechen sowie wiederholte Episoden von wässrigem Durchfall (z. B. mehr als 1 Mal pro Stunde) deuten auf die Notwendigkeit einer spezifischen Behandlung hin.
- Das RKI hält eine Krankenhauseinweisung dann für notwendig, wenn eine intravenöse Flüssigkeitszufuhr benötigt wird. Dies wird am Exsikkosegrad festgemacht: Stellt sich ein Verlust ab 6 % des Körpergewichts an Flüssigkeit ein, wird ein Infusionsbedarf je nach Alter des Kindes immer wahrscheinlicher, insbesondere wenn zusätzlich die orale Rehydratation immer mehr verweigert wird (Vega & Avva, 2024).
- Behandlungsansätze zielen auf eine Linderung der Symptome und Wiederherstellung der physiologischen Funktion ab.
- Als wichtigste Behandlungsansätze gelten Flüssigkeits- und Elektrolytmanagement (einschließlich orale Hydratationslösung und intravenöse Rehydrierung), Ernährungsmanagement und der Einsatz von Probiotika.
(Anderson & Weber, 2004; Robert Koch-Institut, 2010; Crawford et al., 2017)
Epidemiologie
Europa und weltweit
- Rotaviren sind der häufigste Durchfallerreger im Säuglings- und Kleinkindalter: 90 % der Kinder haben bis zum Alter von 3 Jahren eine Infektion durchgemacht, bis zum Alter von 5 Jahren sind es nahezu alle (Robert Koch-Institut, 2024a).
- Die Zahl der weltweiten rotavirusbedingten Todesfälle bei Kindern unter 5 Jahren wird für das Jahr 2016 auf 128.500 (Spannbreite 104.500 bis 155.600) geschätzt – in der EU sind es nur etwa 230 Todesfälle (Shai et al., 2013; Troeger et al., 2018).
- Rotaviren kommen weltweit (sowohl in Industrie- als auch in Entwicklungsländern) mit ähnlicher Infektionshäufigkeit, aber mit unterschiedlichem Schweregrad vor und infizieren dabei vor allem Kinder unter 5 Jahren (Dennehy, 2008; LeClair & McConnell, 2024).
- Dies deutet darauf hin, dass gute Hygiene, sauberes Trink- und Nutzwasser sowie die Verbesserung anderer sozioökomischer Standards einen marginalen Effekt auf die Verringerung von Rotavirus-Infektionen, aber einen nachweisbaren Effekt auf die Schwere der Erkrankungen und den Tod haben (Dennehy, 2008; Asare et al., 2022; European Centre for Disease Prevention and Control, 2023).
- In Entwicklungsländern kommt Rotaviren dementsprechend eine andere Bedeutung als in Industrieländern zu, da sie wesentlich zur Mortalität im Kindesalter beitragen (Robert Koch-Institut, 2010).
- Infektionen erfolgen vor allem in Winterperioden gemäßigter Klimazonen. In tropischen Klimazonen treten sie dagegen nicht saisonal auf (LeClair & McConnell, 2024).
- Vor Einführung der Impfstoffe 2006 wurden in den USA jährlich 20 bis 70 rotavirusbedingte Todesfälle gemeldet. Die Anzahl von 400.000 Arztbesuchen und 55.000 bis 70.000 Hospitalisierungen war dabei wesentlich höher, was auf eine hohe Morbidität, aber geringe Mortalität schließen lässt. Die Impfstoffe haben ihren primären Nutzen in der Senkung der Krankheitslast (Anderson & Weber, 2004; Dennehy, 2008).
- Durch die Auswertung der Zeiträume vor und nach der Einführung der Impfstoffe in den USA konnte in verschiedenen Studien (sowohl retrospektive als auch prospektive angelegte Untersuchungen) gezeigt werden, dass die rotavirusbedingten Krankenhausaufenthalte um 60 bis 93 % (je nach Population und Durchimpfungsrate) reduziert wurden. In der Nicht-Rotavirus-Saison konnten jedoch keine signifikanten Effekte festgestellt werden (Dennehy, 2013).
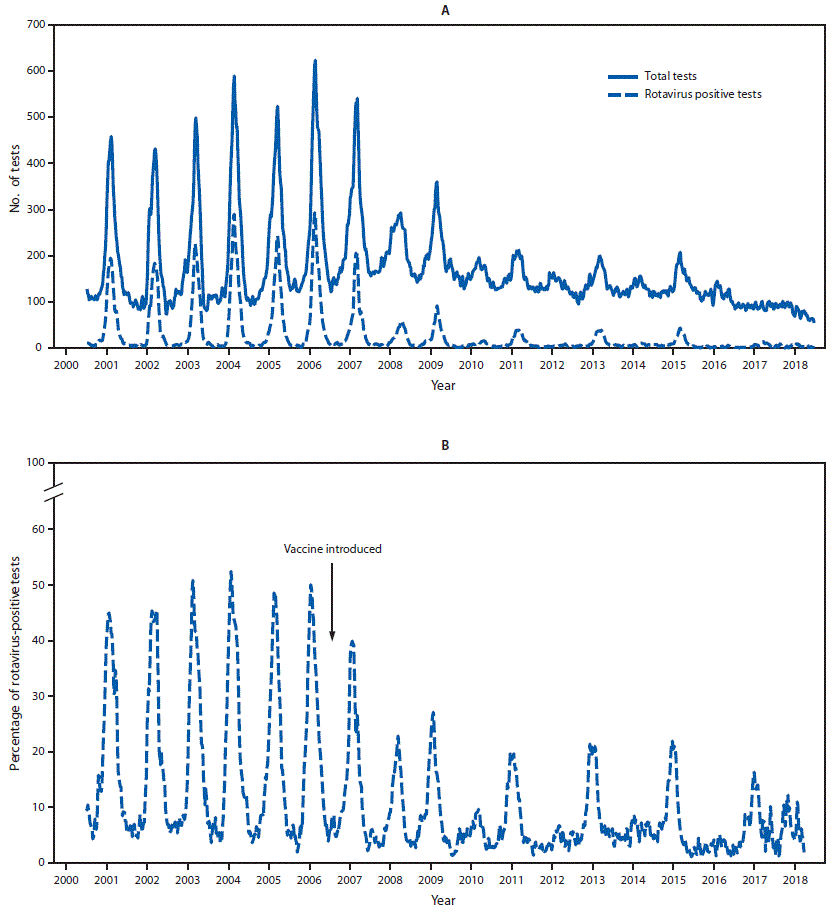
- In allen Saisons von 2007/2008 bis 2017/2018 lag die jährliche Rotavirusaktivität in den USA durchgängig unter der jährlichen Aktivität der Saisons 2000/2001 bis 2006/2007 (vor der Impfung) und diese waren auch kürzer. Der Rückgang beim Anteil positiver Rotavirus-Tests spricht zudem gegen Verzerrungen, die durch die Teststrategie bedingt sein können wie z. B. zunehmender Einsatz von PCR-Tests zum Nachweis mehrerer Erreger (Hallowell et al., 2019).
Abbildung 4: Gesamtzahl der Rotavirus-Tests und positiven Rotavirus-Tests (A) und prozentuale Positivität (B) unter den 23 kontinuierlich berichtenden Labors des National Respiratory and Enteric Virus Surveillance System (NREVSS der Vereinigte Staaten (USA) von 2000 bis 2018 (Hallowell et al., 2019).
Deutschland
- Jährlich werden etwa 1 bis 2 Todesfälle durch Rotaviren bei Kindern unter 5 Jahren in Deutschland gemeldet (European Centre for Disease Prevention and Control, 2017).
- Die Zahl der jährlichen Rotavirus-Gastroenteritis-Fälle liegt dagegen sehr viel höher: Abgesehen von den Pandemiejahren 2020 und 2021 bewegt sich die Anzahl zwischen 26.131 (2018) und 81.241 (2008) jährlichen Fällen. Seit Einführung der Impfung in die Standardempfehlung der STIKO kann ein diskontinuierlicher Rückgang der Fallzahl beobachtet werden (Robert Koch-Institut, 2024b).
- Etwa 9 % der gemeldeten Erkrankungen von Kindern werden im Krankenhaus erworben (nosokomial) (arznei-telegramm, 2013).
Abbildung 5: Jährliche Rotavirus-Gastroenteritis-Fälle von 2001 bis 2023 in Deutschland (Robert Koch-Institut, 2024b).
- Rotaviren: Die Impfung
Zugelassene Impfstoffe
- 2006 wurden die beiden Impfstoffe Rotarix® und RotaTeq® in Deutschland zugelassen, seit Juli 2013 sind sie von der STIKO standardmäßig für Säuglinge unter 6 Monaten empfohlen (Robert Koch-Institut, 2010).
- Es handelt sich dabei um Schluckimpfungen mit einem oralen Lebendimpfstoff.
- Ein bereits in den USA zugelassener Rotavirus-Impfstoff (Rotashield®) musste wieder vom Markt genommen werden, als Darminvaginationen als starkes Sicherheitssignal (1:10.000 zusätzliche Fälle) entdeckt wurden. Auch bei Rotarix® und RotaTeq® kann es in sehr seltenen Fällen (< 1/10.000 Personen) dazu kommen (Dong et al., 2016; European Medicines Agency, 2023a, 2023b; Robert Koch-Institut, 2024a).
- Da das Risiko von Darminvaginationen mit dem Alter ansteigt, empfiehlt die STIKO bereits frühzeitig (im Alter von 6 bis 12 Wochen) mit der Impfserie zu beginnen und für Rotarix® bis zum Alter von 24 Wochen und RotaTeq® bis zum Alter von 32 Wochen abzuschließen (Robert Koch-Institut, 2024a).
Ab 6 Wochen zugelassen
Impfstoffname
Impfstoffart
Darreichung
Inhaltsstoffe
Rotarix®
Rotavirus-Schluckimpfung (lebend, attenuiert), monovalent
Pulver und Lösungsmittel zur Herstellung einer Suspension; weißes Pulver und trübe Flüssigkeit
Nach der Rekonstitution enthält 1 Dosis (1 ml): Humanes Rotavirus, RIX4414-Stamm (lebend, attenuiert; hergestellt in Vero-Zellen) mindestens 106,0 ZKID50; sonstige Bestandteile mit bekannter Wirkung: Sorbitol (E 420) 13,5 mg, Saccharose 9 mg, Glucose 10 µg, Phenylalanin 0,15 µg; Liste der sonstigen Bestandteile: Dextran, Aminosäuren, Dulbecco‘s modifiziertes Eagle-Medium / DMEM (enthält Phenylalanin, Natrium, Glucose und andere Substanzen)
RotaTeq®
Rotavirus-Schluckimpfung (lebend, attenuiert), pentavalent
Lösung zum Einnehmen;
klare, blassgelbe Lösung, eventuell mit rosa Farbstich.
Eine Dosis (2 ml) enthält: Rotaviren (lebende human-bovine Rotavirus-Reassortanten, gezüchtet in Vero-Zellen) Typen G1 & G3 (mind. 2,2 x 106 IE [infektiöse Einheiten]), Typ G2 (mind. 2,8 x 106 IE), Typ G4 (mind. 2,0 x 106 IE), Typ P1A[8] (mind. 2,3 x 106 IE); sonstige Bestandteile mit bekannter Wirkung: Sucrose 1.08 mg, Natrium 37,6 mg; Liste der sonstigen Bestandteile: Natriumcitrat Natriumdihydrogenphosphat-Monohydrat, Natriumhydroxid, Polysorbat 80, Nährmedien (enthalten anorganische Salze, Aminosäuren und Vitamine), gereinigtes Wasser
Tabelle 1: In Deutschland zugelassene Rotavirus-Impfstoffe, ihre Darreichung und Inhaltsstoffe (European Medicines Agency, 2023a, 2023b).
Effektivität und Impfstrategie
- In einem sehr umfangreichen systematischen Cochrane-Review wurde die Impfstoffeffektivität (VE) von vier verschiedenen Rotavirus-Impfstoffen anhand von 60 relevanten RCTs (36 zu Rotarix®, 15 zu RotaTeq®, 5 zu Rotasiil® und 4 zu Rotavac®) mit insgesamt 228.233 Probanden bewertet. Die VE zur Verhinderung von schwerem rotavirusbedingtem Durchfall betrug in den ersten beiden Lebensjahren der geimpften Kinder in Ländern mit niedriger Kindersterblichkeitsrate mehr als 90 %, in Ländern mit mittlerer Kindersterblichkeitsrate 75 % und in Ländern mit hoher Kindersterblichkeitsrate 35 bis 58 %. Allerdings konnten keine Unterschiede hinsichtlich der Todesfälle festgestellt werden. Da 56 der 60 Studien vollständig oder teilweise von den Impfstoffherstellern finanziert wurden, besteht ein gewisses Verzerrungsrisiko (Bergman et al., 2021).
- Im Grunde genommen zeigt das Cochrane-Review auf höchster Evidenz-Stufe erneut auf, was andere Studien schon zuvor finden konnten: Die Impfstoffe vermitteln einen guten Schutz vor schweren Erkrankungen und Krankenhauseinweisungen, wobei die Impfeffektivität in Industrieländern höher liegt als in Schwellen- und Entwicklungsländern (Lamberti et al., 2016; Jonesteller et al., 2017; Burnett et al., 2020); in Industrieländern, in denen die Fallsterblichkeit gering ist und kaum Todesfälle durch Rotaviren entstehen, gibt es keine oder nur sehr limitierte Evidenz hinsichtlich der Reduzierung der Todesfälle (All-Cause-Mortality) (Ruiz-Palacios et al., 2006).
Replacement
- Da verschiedene Serogruppen an Rotaviren bestehen, ist es durchaus denkbar, dass die Verdrängung vorherrschender Serogruppen den Nutzen der Impfung beeinflussen kann (arznei-telegramm, 2013).
- Studien aus Belgien, Brasilien und den USA haben ein erhöhtes Vorkommen der Stämme G2 und G3 kurz nach Einführung der Impfstoffe in das nationale Immunisierungsprogramm gemessen (Koch et al., 2013). RotaTeq® berücksichtigt diese beiden Stämme.
- Ein neueres systematisches Review mit Meta-Analyse von langjährigen Überwachungsdaten kann ein Replacement jedoch nicht bestätigen: Die von den o. g. Studien beschriebene Stammentwicklung war nur vorübergehend, nicht von selektivem Druck geprägt und es konnte kein klares Muster entdeckt werden. Zeitliche und regionale Schwankungen in der Stammverteilung gelten nach derzeitigem Wissensstand also als unabhängig von der Impfung. Auch wurden bisher keine neuen durch die Impfviren entstandenen Stämme entdeckt. Sowohl langsame Verschiebungen der Stammprävalenzen als auch neu auftretende Stämme durch die Impfung können jedoch laut den Studienautoren nicht ausgeschlossen werden, sodass eine weitere Überwachung notwendig ist (Cates et al., 2021).
Adjuvantien
- Da es sich bei den Rotavirus-Impfstoffen um Schluckimpfungen handelt, werden keine Zusatzstoffe wie Aluminiumverbindungen, die eine Stimulation des Immunsystems und Depotfreigabe des Wirkstoffs ermöglichen, benötigt.
- In RotaTeq® kommt allerdings Polysorbat 80 vor, ein Lösungsmittel, das in Tierexperimenten eine gewisse Toxizität aufwies und z. B. oral verabreicht bei Mäusen und Ratten unterschiedlichste Auswirkungen hatte (z. B. Dämpfung des zentralen Nervensystems mit Verringerung der Bewegungsaktivität und der Rektaltemperatur, teilweise auch Ataxie und paralytische Wirkungen). Weiterhin wird es in unterstützenden Produkten für die Chemotherapie verwendet und dort mit unerwünschten und systemischen Ereignissen in Verbindung gebracht. Weitere Untersuchungen bezüglich der Sicherheit sind daher unerlässlich (Varma et al., 1985; Schwartzberg & Navari, 2018).
Nebenwirkungen
Hinweis: Um die Tabelle vollständig anzuzeigen, scrollen Sie bitte mit Maus oder Touchpad nach rechts und links.
Impfstoff
Sehr häufig (>1/10)
Häufig
(≥ 1/100 bis
< 1/10)Gelegentlich (≥ 1/1.000 bis < 1/100)
Selten
(≥ 1/10.000 bis < 1/1.000)
Sehr selten
(< 1/
10.000)
Unbekannt / weitere mögliche Nebenwirkungen / Post-Marketing-Surveillance
Rotarix®
Durchfall, Reizbarkeit
Bauchschmerzen, Blähungen, Dermatitis
Invagination, Urtikaria
Blut im Stuhl, Gastroenteritis verbunden mit einer Ausscheidung (Shedding) des Impfvirus bei Säuglingen mit einem schweren kombinierten Immundefekt (SCID), Apnoe bei sehr unreifen Frühgeborenen (vor der vollendeten 28. SSW)
RotaTeq®
Durchfall, Erbrechen, Fieber
Infektionen der oberen Atemwege
Nasopharyngitis, Otitis media, Hämatochezie, Oberbauchschmerzen, Ausschlag
Bronchospasmus, Urtikaria
Invagination
Anaphylaktische Reaktion, Angioödem, Reizbarkeit
Tabelle 2: Nebenwirkungen der an Säuglingen getesteten Rotavirus-Impfstoffe Rotarix® und RotaTeq®. (European Medicines Agency, 2023a, 2023b).
- In dem bereits unter Effektivität und Impfstrategie (LINK) erwähnten systematischen Cochrane-Review wurden keine oder nur geringfügige Unterschiede in der Anzahl der Nebenwirkungen zwischen den Impfstoff- und Plazebogruppen ermittelt. Ebenso wurden nur leichte oder sogar keine Unterschiede zwischen der Anzahl der Darminvaginationen zwischen den Gruppen beobachtet – die Evidenz hierfür ist jedoch sehr beschränkt, da die Studien nicht darauf ausgelegt und umfangreich genug gewesen sind, um dies näher zu untersuchen (Bergman et al., 2021).
- Aufgrund zweier durch Darminvaginationen bedingte Todesfälle im zeitlichen Zusammenhang mit der Rotavirus-Impfung hat die oberste französische Gesundheitsbehörde (Haut Conseil de la santé publique / Hoher Rat für öffentliche Gesundheit, HCSP) die Rotavirus-Impfempfehlung 2015 aufgehoben. 16 der 17 anwesenden Mitglieder stimmten dafür. Durch neue Daten zu Nebenwirkungen (508 Nebenwirkungen bei über 1 Million verimpfte Dosen, davon 201 bzw. 39,6 % schwerwiegend und 47 Darminvaginationen; umgerechnet insgesamt 103,4 Fälle pro 100.000 geimpfte Säuglinge) ist der HCSP 2015 zu einem negativen Ergebnis bei der Nutzen-Schaden-Abwägung gelangt, insbesondere unter dem Blickwinkel, dass es sich bei Frankreich um ein Industrieland handelt. Letztlich erinnert der HCSP in der Stellungnahme daran, dass bereits 2006 und 2010 eine Entscheidung gegen die allgemeine Impfempfehlung getroffen wurde und die 2013 eingeführte Impfempfehlung für Rotaviren auch nicht in den Impfkalender übernommen wurde, da weitere Bewertungen u. a. durch den Transparenzausschuss noch ausstanden (Haut Conseil de la santé publique, 2015).
- Für die STIKO und das PEI ergab das keinen Grund, die Rotavirus-Impfempfehlung erneut auf den Prüfstein zu stellen (Robert Koch-Institut, 2015). Auch die WHO sieht in den Impfstoffen ein „gutes Sicherheitsprofil“ und empfiehlt die Implementierung in „alle nationalen Immunisierungsprogramme“ (World Health Organization, 2021). Daher wird im Folgenden genauer auf das Thema eingegangen.
- Seit Juni 2022 empfiehlt der HCSP die Rotavirus-Impfung für Frankreich wieder. Dies wird unter anderem mit dem langjährigen sicheren und wirksamen Einsatz der Impfstoffe in anderen Ländern begründet (Santé Publique France, 2023a, 2023b).
Darminvaginationen
Zum Vergleich: Der Impfstoff Rotashield® wurde in den USA aufgrund eines zusätzlichen Risikos von über 10 Fällen von Darminvaginationen pro 100.000 geimpften Kindern vom Markt genommen (Dong et al., 2016).
- Eine Meta-Analyse zu 6 Kohorten-Studien (4,5 Mio. Erstdosen) und 5 Fall-Kontroll-Studien (mit 9.643 Kindern) konnte aufzeigen, dass bei Rotarix® und RotaTeq®ein erhöhtes Risiko für Darminvaginationen innerhalb der ersten 7 Tage nach Verabreichung der ersten Impfstoffdosis und in geringerem Maße auch nach Erhalt aller weiteren Dosen bestand (Kassim & Eslick, 2017).
- Weitere Meta-Analysen, u. a. der Post-Marketing-Surveillance-Studien, bestätigen diesen Befund (Rosillon et al., 2015; Dong et al., 2016).
- Das RKI schätzt, dass innerhalb der ersten Woche nach Verabreichung der ersten Impfstoffdosis 1 bis 2 zusätzliche Fälle an Darminvaginationen pro 100.000 geimpfte Kinder auftreten (Exzessrisiko). Diese Schätzung ist konsistent mit den Daten eines von der amerikanischen Food and Drug Administration gesponsorten Mini-Sentinel-Programms zu RotaTeq® und einem im Deutschen Ärzteblatt veröffentlichten systematischen Review mit Meta-Analyse (Yih et al., 2014; Koch et al., 2017; Robert Koch-Institut, 2024a).
- Die CDC gehen im Gegensatz zum RKI von einer etwas höheren Häufigkeit von zusätzlichen 1:20.000 bis 1:100.000 (1 bis 5 pro 100.000) geimpften Kindern mit Darminvagination aus (Centers for Disease Control and Prevention, 2017).
- Daten des amerikanischen Spontanmeldesystems VAERS von 2008 bis 2014 zeigen in der Sensitivitätsanalyse eine Prävalenz von 1,2 bis 2,8 Fällen pro 100.000 geimpften Kindern (Haber et al., 2015). Naturgemäß muss hier von einer starken Untererfassung ausgegangen werden, da das System auf Meldungen aus der Bevölkerung angewiesen ist.
- Nach einer Überprüfung der verfügbaren Daten durch die EMA wurden die EU-Zusammenfassungen der Produktmerkmale (SPC) für beide Rotavirus-Impfstoffe im Mai 2014 aktualisiert: „Daten aus Sicherheitsbeobachtungsstudien, die in mehreren Ländern durchgeführt wurden, deuten darauf hin, dass Rotavirus-Impfstoffe ein erhöhtes Risiko für Darminfektionen bergen, meist innerhalb von 7 Tagen nach der Impfung. In den USA und Australien wurden bis zu 6 zusätzliche Fälle pro 100.000 Säuglinge beobachtet, während die Hintergrundinzidenz bei 33 bis 101 pro 100.000 Säuglingen (unter einem Jahr) pro Jahr lag. Es gibt begrenzte Hinweise auf ein geringeres erhöhtes Risiko nach der zweiten Dosis. Es ist nach wie vor unklar, ob Rotavirus-Impfstoffe die Gesamtinzidenz von Darminfektionen bei längerer Beobachtung beeinflussen.“ [Übersetzt aus dem Englischen] (European Centre for Disease Prevention and Control, 2017)
Im Vehältnis zu dem vom Markt genommenen Rotashield® haben Rotarix® und RotaTeq® zwar etwas besser abgeschnitten, dennoch besteht ein erhöhtes Risiko für lebensbedrohliche Darminvaginationen, das mindestens weiter überwacht werden muss, dringender aber in dem Industrieland Deutschland, in dem es nur 1-2 Todesfälle pro Jahr gibt, zu einer erneuten Nutzen-Schaden-Abwägung der Impfstoffe gegen Rotaviren wie 2015 in Frankreich führen müsste.
Unspezifische Effekte
- Eine niederländische quasi-experimentelle Vorher-Nachher-Studie untersuchte unspezifische Wirkungen der Rotavirus-Impfung an Säuglingen mit medizinischen Risikofaktoren. Zusätzlich wurden prospektiv Daten mithilfe von monatlichen Fragebögen erhoben. Es wurden nur minimale oder keine unspezifische Wirkungen in Bezug auf akute Krankenhausaufenthalte, akute Atemwegserkrankungen oder Ekzeme bei Säuglingen festgestellt (van Dongen et al., 2021).
- Es gibt Hinweise darauf, dass die Rotavirus-Impfstoffe nicht nur vor rotavirusbedingten Gastroenteriden schützen, sondern auch vor Gastroenteriden, die durch andere Enteropathogene verursacht werden. Dies wird unter anderem auch deshalb angenommen, weil die Rotavirus-Impfstoffe die All-Cause-Gastroenteritis-Fälle stärker reduzieren, als es durch die Reduktion des Anteils, den Rotaviren an den Gastroenteritis-Fällen ausmachen, in verschiedenen Ländern zu erwarten gewesen wäre (Glass, 2011; Mandolo et al., 2021; Benedicto-Matambo et al., 2022).
Sonstiges
- Laut dem industrieunabhängigen arznei-telegramm sind die Rotavirus-Impfstoffe „weit davon entfernt, kosteneffektiv zu sein“: Eine gesundheitsökonomische Analyse beziffert die Mehrkosten für einen geimpften Jahrgang trotz der Senkung der Krankheitslast bzw. Hospitalisierungen/Arztbesuche auf 45 bis 48 Mio. Euro. Erst bei Senkung der Impfstoffpreise um ca. 2/3 wären Kosteneinsparungen möglich (arznei-telegramm, 2013).
- Rotaviren: Die STIKO-Empfehlungen
Die Empfehlungen
- Ab dem Alter von 6 Wochen erfolgen zwei (Rotarix®) bzw. drei Impfdosen (RotaTeq®) mit einem Mindestabstand von 4 Wochen.
- Die Altersbegrenzung des Kindes von 24 Wochen für Rotarix® und für 32 Wochen für RotaTeq® sollte aufgrund des mit dem Alter zunehmenden Risikos von Darminvaginationen strikt eingehalten werden.
- Frühgeborene sollen genauso geimpft werden, aber je nach Schwangerschaftswoche mit unterschiedlichen Impfstoffen (RotaTeq® ab der 25., Rotarix® ab der 27. SSW).
- Der Impfstoff muss nicht erneut verabreicht werden, wenn das Kind den Impfstoff ausspuckt. Nur wenn das Kind den Impfstoff größtenteils erbrochen hat, kann bei dem entsprechenden Impftermin eine erneute Gabe erfolgen.
- Bei leichten Infektionen kann geimpft werden, nicht aber bei schwereren Erkrankungen (wie einer Rotavirus-Gastroenteritis).
- Kinder, die bereits eine Rotavirus-Infektion durchgemacht haben, sollen laut STIKO auch eine Impfung erhalten, da die Infektion nur einen unvollständigen Schutz bietet.
- Bis zu einer Stunde vor und nach der Impfung soll auf das Stillen verzichtet werden, da dies womöglich die Wirkung der Impfung beeinflussen kann.
- In manchen Fällen werden Impfviren bis zu 7 Tage nach Verabreichung des Impfstoffes mit dem Stuhl ausgeschieden. Der Anteil der Kinder, bei denen das vorkommt, wird mit jeder weiteren Impfung geringer. Kontaktpersonen sollen in dieser Zeit besonders auf Hygiene achten (insbesondere beim Wickeln).
- Wenn Säuglinge Kontakt zu immungeschwächten Personen haben, sollte die Impfung aufgrund möglicher Komplikationen für die Kontaktpersonen durch die Ausscheidung von Impfviren über den geimpften Säugling gut überlegt sein.
(Robert Koch-Institut, 2013, 2024a)
Kritik an den STIKO-Empfehlungen
Es gibt nur wenige Argumente, die für eine allgemeine Empfehlung der Rotavirus-Impfung sprechen, darunter die sehr effektive Senkung der Krankheitslast (Morbidität) in Ländern mit geringer Kindersterblichkeit. Dem steht jedoch entgegen, dass …
- … keine ausreichenden Daten zur Verringerung der Sterblichkeit (All-Cause-Mortality) vorliegen.
- … nach der Impfung vermehrt lebensbedrohliche Darminvaginationen auftreten können (bis zu 6 Fälle mehr pro 100.000 geimpften Kindern). Die Häufigkeit ist nicht wesentlich geringer als bei dem Impfstoff Rotashield®, der bereits vom Markt genommen wurde (wegen >10 Fällen pro 100.000 geimpften Kindern). Frankreich hatte aus diesen Gründen die Impfempfehlung 2015 zurückgenommen.
- … die Rotavirus-Impfstoffe nicht kosteneffektiv sind, sondern Mehrkosten im Gesundheitssystem von schätzungsweise 45 bis 48 Millionen Euro pro geimpften Jahrgang verursachen.
- … es bis zu 7 Tage nach der Impfung zu einer Infektion von Kontaktpersonen mit dem Impfvirus kommen kann. Daher bedarf die Impfung des Kindes einer Abwägung, wenn im Umfeld immungeschwächte Personen vorhanden sind.
- … 90 % bis zum Alter von 3 Jahren und nahezu jedes Kind bis zum Alter von 5 Jahren eine Infektion durchmacht. Nach nur einer Infektion erhalten wahrscheinlich 38 % der Kinder eine lebenslange Immunität vor allen weiteren Infektionen und 87 % sind gegen schweren Durchfall geschützt.
Gerade in Industrieländern, in denen Rotavirus-Todesfälle eine Rarität sind (Deutschland: etwa 1-2 pro Jahr bzw. unter 0,1 pro 100.000 Einwohner) und in denen sich die Krankheit gut behandeln lässt, stellt sich die Frage, welches primäre Ziel nationale Immunisierungsprogramme verfolgen (sollten). Bei allen anderen Impfungen ist die Senkung der Mortalität der wichtigste Grund. Dass die Rotavirus-Impfung hier eine Ausnahme darstellt, spricht stark für eine individuelle Impfberatung und gegen eine allgemeine Impfempfehlung.
- Literaturverzeichnis
Akinola, M. T., Uba, A., Umar, A. F., & Agbo, E. B. (2020). Asymptomatic Rotavirus Infections among Children in Maiduguri, Borno State, Northeast, Nigeria. Annals of African Medicine, 19(3), 198–202. https://doi.org/10.4103/aam.aam_55_19
Amar, C. F. L., East, C. L., Gray, J., Iturriza-Gomara, M., Maclure, E. A., & McLauchlin, J. (2007). Detection by PCR of eight groups of enteric pathogens in 4,627 faecal samples: Re-examination of the English case-control Infectious Intestinal Disease Study (1993-1996). European Journal of Clinical Microbiology & Infectious Diseases: Official Publication of the European Society of Clinical Microbiology, 26(5), 311–323. https://doi.org/10.1007/s10096-007-0290-8
Aminu, M., Esona, M. D., Geyer, A., & Steele, A. D. (2008). Epidemiology of rotavirus and astrovirus infections in children in northwestern Nigeria. Annals of African Medicine, 7(4), 168–174. https://doi.org/10.4103/1596-3519.55658
Anderson, E. J., & Weber, S. G. (2004). Rotavirus infection in adults. The Lancet. Infectious Diseases, 4(2), 91–99. https://doi.org/10.1016/S1473-3099(04)00928-4
arznei-telegramm. (2013, September 13). Impfung gegen Rotaviren für alle Säuglinge? arznei-telegramm.de. https://www.arznei-telegramm.de/html/2013_09/1309076_01.html
Asare, E. O., Hergott, D., Seiler, J., Morgan, B., Archer, H., Wiyeh, A. B., Guo, B., Driver, M., Giersing, B., Hasso-Agopsowicz, M., Lingappa, J., Lopman, B. A., & Pitzer, V. E. (2022). Case fatality risk of diarrhoeal pathogens: A systematic review and meta-analysis. International Journal of Epidemiology, 51(5), 1469. https://doi.org/10.1093/ije/dyac098
Barrón-Romero, B. L., Barreda-González, J., Doval-Ugalde, R., Zermeño-Eguia Liz, J., & Huerta-Peña, M. (1985). Asymptomatic rotavirus infections in day care centers. Journal of Clinical Microbiology, 22(1), 116–118.
Benedicto-Matambo, P., Bines, J. E., Malamba-Banda, C., Shawa, I. T., Barnes, K., Kamng’ona, A. W., Hungerford, D., Jambo, K. C., Iturriza-Gomara, M., Cunliffe, N. A., Flanagan, K. L., & Jere, K. C. (2022). Leveraging Beneficial Off-Target Effects of Live-Attenuated Rotavirus Vaccines. Vaccines, 10(3), 418. https://doi.org/10.3390/vaccines10030418
Bergman, H., Henschke, N., Hungerford, D., Pitan, F., Ndwandwe, D., Cunliffe, N., & Soares-Weiser, K. (2021). Vaccines for preventing rotavirus diarrhoea: Vaccines in use. Cochrane Database of Systematic Reviews, 11. https://doi.org/10.1002/14651858.CD008521.pub6
Bernstein, D. I. (2009). Rotavirus overview. The Pediatric Infectious Disease Journal, 28(3 Suppl), S50-53. https://doi.org/10.1097/INF.0b013e3181967bee
Binka, F. N., Anto, F. K., Oduro, A. R., Awini, E. A., Nazzar, A. K., Armah, G. E., Asmah, R. H., Hall, A. J., Cutts, F., Alexander, N., Brown, D., Green, J., Gray, J., Iturriza-Gómara, M., & Navrongo Rotavirus Research Group. (2003). Incidence and risk factors of paediatric rotavirus diarrhoea in northern Ghana. Tropical Medicine & International Health: TM & IH, 8(9), 840–846. https://doi.org/10.1046/j.1365-3156.2003.01097.x
Bishop, R. F., Barnes, G. L., Cipriani, E., & Lund, J. S. (1983). Clinical immunity after neonatal rotavirus infection. A prospective longitudinal study in young children. The New England Journal of Medicine, 309(2), 72–76. https://doi.org/10.1056/NEJM198307143090203
Brandt, C. D., Kim, H. W., Rodriguez, W. J., Arrobio, J. O., Jeffries, B. C., & Parrott, R. H. (1982). Rotavirus gastroenteritis and weather. Journal of Clinical Microbiology, 16(3), 478–482. https://doi.org/10.1128/jcm.16.3.478-482.1982
Burnett, E., Parashar, U. D., & Tate, J. E. (2020). Real-world effectiveness of rotavirus vaccines, 2006–19: A literature review and meta-analysis. The Lancet Global Health, 8(9), e1195–e1202. https://doi.org/10.1016/S2214-109X(20)30262-X
Cates, J. E., Amin, A. B., Tate, J. E., Lopman, B., & Parashar, U. (2021). Do Rotavirus Strains Affect Vaccine Effectiveness? A Systematic Review and Meta-analysis. The Pediatric Infectious Disease Journal, 40(12), 1135–1143. https://doi.org/10.1097/INF.0000000000003286
Centers for Disease Control and Prevention. (2017, Januar 27). Questions & Answers about Intussusception and Rotavirus Vaccine. Cdc.Gov. https://www.cdc.gov/vaccines/vpd/rotavirus/about-intussusception.html
Centers for Disease Control and Prevention. (2021, August 18). Rotavirus. Pinkbook. www.cdc.gov/vaccines/pubs/pinkbook/rota.html
Champsaur, H., Henry-Amar, M., Goldszmidt, D., Prevot, J., Bourjouane, M., Questiaux, E., & Bach, C. (1984). Rotavirus carriage, asymptomatic infection, and disease in the first two years of life. II. Serological response. The Journal of Infectious Diseases, 149(5), 675–682. https://doi.org/10.1093/infdis/149.5.675
Crawford, S. E., Ramani, S., Tate, J. E., Parashar, U. D., Svensson, L., Hagbom, M., Franco, M. A., Greenberg, H. B., O’Ryan, M., Kang, G., Desselberger, U., & Estes, M. K. (2017). Rotavirus infection. Nature reviews. Disease primers, 3, 17083. https://doi.org/10.1038/nrdp.2017.83
Dennehy, P. H. (2000). Transmission of rotavirus and other enteric pathogens in the home. The Pediatric Infectious Disease Journal, 19(10), S103. https://doi.org/10.1097/00006454-200010001-00003
Dennehy, P. H. (2008). Rotavirus Vaccines: An Overview. Clinical Microbiology Reviews, 21(1), 198–208. https://doi.org/10.1128/CMR.00029-07
Dennehy, P. H. (2013). Treatment and prevention of rotavirus infection in children. Current Infectious Disease Reports, 15(3), 242–250. https://doi.org/10.1007/s11908-013-0333-5
Dennehy, P. H., Nelson, S. M., Crowley, B. A., & Saracen, C. L. (1998). Detection of Rotavirus RNA in Hospital Air Samples by Polymerase Chain Reaction (PCR) • 828. Pediatric Research, 43(4), Article 4. https://doi.org/10.1203/00006450-199804001-00849
Dong, R., Yang, Y., Chen, G., Shen, Z., & Zheng, S. (2016). Risk of intussusception after rotavirus vaccination: A meta-analysis. https://www.semanticscholar.org/paper/Risk-of-intussusception-after-rotavirus-vaccination-Dong-Yang/e3a04aa79318b9d252719caa004487cdfea59669
Estes, M. K., Kang, G., Zeng, C. Q., Crawford, S. E., & Ciarlet, M. (2001). Pathogenesis of rotavirus gastroenteritis. Novartis Foundation Symposium, 238, 82–96; discussion 96-100. https://doi.org/10.1002/0470846534.ch6
European Centre for Disease Prevention and Control. (2017, September). Scientific Advice: Expert opinion on rotavirus vaccination in infancy. Ecdc.Europa.Eu. https://data.europa.eu/doi/10.2900/362947
European Centre for Disease Prevention and Control. (2023, Dezember 1). Disease factsheet about rotavirus. Ecdc.Europa.Eu. https://www.ecdc.europa.eu/en/rotavirus-infection/facts
European Medicines Agency. (2023a, April 4). RotaTeq Fachinformation. ema.europa.eu. https://www.ema.europa.eu/de/documents/product-information/rotateq-epar-product-information_de.pdf
European Medicines Agency. (2023b, Juli 31). Rotarix Fachinformation. ema.europa.eu. https://www.ema.europa.eu/de/documents/product-information/rotarix-epar-product-information_de.pdf
Flewett, T. H. (1983). Rotavirus in the home and hospital nursery. British Medical Journal (Clinical research ed.), 287(6392), 568–569. https://doi.org/10.1136/bmj.287.6392.568
Glass, R. I. (2011). Unexpected Benefits of Rotavirus Vaccination in the United States. The Journal of Infectious Diseases, 204(7), 975–977. https://doi.org/10.1093/infdis/jir477
Haber, P., Parashar, U. D., Haber, M., & DeStefano, F. (2015). Intussusception after monovalent rotavirus vaccine-United States, Vaccine Adverse Event Reporting System (VAERS), 2008-2014. Vaccine, 33(38), 4873–4877. https://doi.org/10.1016/j.vaccine.2015.07.054
Hallowell, B. D., Parashar, U. D., Curns, A., DeGroote, N. P., & Tate, J. E. (2019). Trends in the Laboratory Detection of Rotavirus Before and After Implementation of Routine Rotavirus Vaccination—United States, 2000-2018. MMWR. Morbidity and Mortality Weekly Report, 68(24), 539–543. https://doi.org/10.15585/mmwr.mm6824a2
Haut Conseil de la santé publique. (2015, April 21). Stellungnahme zur Impfung von Säuglingen gegen Rotavirus-Gastroenteritis (Avis relatif à la vaccination des nourrissons vis-à-vis des gastroentérites à rotavirus). hcsp.fr. http://www.hcsp.fr/Explore.cgi/Telecharger?NomFichier=hcspa20150421_rotavirussusprecovaccnourrisson.pdf
Jonesteller, C. L., Burnett, E., Yen, C., Tate, J. E., & Parashar, U. D. (2017). Effectiveness of Rotavirus Vaccination: A Systematic Review of the First Decade of Global Postlicensure Data, 2006-2016. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, 65(5), 840–850. https://doi.org/10.1093/cid/cix369
Kassim, P., & Eslick, G. D. (2017). Risk of intussusception following rotavirus vaccination: An evidence based meta-analysis of cohort and case-control studies. Vaccine, 35(33), 4276–4286. https://doi.org/10.1016/j.vaccine.2017.05.064
Koch, J., Harder, T., von Kries, R., & Wichmann, O. (2017). Risk of Intussusception After Rotavirus Vaccination. Deutsches Ärzteblatt International, 114(15), 255–262. https://doi.org/10.3238/arztebl.2017.0255
Koch, J., Wiese-Posselt, M., Remschmidt, C., Wichmann, O., Bertelsmann, H., Garbe, E., Hengel, H., Meerpohl, J. J., Mas Marques, A., Oppermann, H., Hummers-Pradier, E., von Kries, R., & Mertens, T. (2013). Background paper to the recommendation for routine rotavirus vaccination of infants in Germany. Bundesgesundheitsblatt, Gesundheitsforschung, Gesundheitsschutz, 56(7), 957–984. https://doi.org/10.1007/s00103-013-1777-3
Krawczyk, A., Lewis, M. G., Venkatesh, B. T., & Nair, S. N. (2016). Effect of Exclusive Breastfeeding on Rotavirus Infection among Children. Indian Journal of Pediatrics, 83(3), 220–225. https://doi.org/10.1007/s12098-015-1854-8
Lamberti, L. M., Ashraf, S., Walker, C. L. F., & Black, R. E. (2016). A Systematic Review of the Effect of Rotavirus Vaccination on Diarrhea Outcomes Among Children Younger Than 5 Years. The Pediatric Infectious Disease Journal, 35(9), 992. https://doi.org/10.1097/INF.0000000000001232
LeClair, C. E., & McConnell, K. A. (2024). Rotavirus. In StatPearls. StatPearls Publishing. http://www.ncbi.nlm.nih.gov/books/NBK558951/
Lundgren, O., & Svensson, L. (2001). Pathogenesis of Rotavirus diarrhea. Microbes and Infection, 3(13), 1145–1156. https://doi.org/10.1016/S1286-4579(01)01475-7
Mandolo, J. J., Henrion, M. Y. R., Mhango, C., Chinyama, E., Wachepa, R., Kanjerwa, O., Malamba-Banda, C., Shawa, I. T., Hungerford, D., Kamng’ona, A. W., Iturriza-Gomara, M., Cunliffe, N. A., & Jere, K. C. (2021). Reduction in Severity of All-Cause Gastroenteritis Requiring Hospitalisation in Children Vaccinated against Rotavirus in Malawi. Viruses, 13(12), 2491. https://doi.org/10.3390/v13122491
Marcinek, K., Zapolnik, P., Radziszewska, R., Ochoda-Mazur, A., Czajka, H., & Pawlik, D. (2023). Rotavirus Vaccination of Premature Newborns in the NICU: Evaluation of Vaccination Rates and Safety Based on a Single-Centre Study. Vaccines, 11(8), 1282. https://doi.org/10.3390/vaccines11081282
Our World in Data. (2018). Rotavirus death rate in children under five, 2016. Ourworldindata.Org. https://ourworldindata.org/grapher/death-rate-from-rotavirus-children-under-5
Phillips, G., Lopman, B., Rodrigues, L. C., & Tam, C. C. (2010). Asymptomatic rotavirus infections in England: Prevalence, characteristics, and risk factors. American Journal of Epidemiology, 171(9), 1023–1030. https://doi.org/10.1093/aje/kwq050
Ramani, S., Sowmyanarayanan, T. V., Gladstone, B. P., Bhowmick, K., Asirvatham, J. R., Jana, A. K., Kuruvilla, K. A., Kumar, M., Gibikote, S., & Kang, G. (2008). Rotavirus infection in the neonatal nurseries of a tertiary care hospital in India. The Pediatric Infectious Disease Journal, 27(8), 719–723. https://doi.org/10.1097/INF.0b013e3181715170
Robert Koch-Institut. (2010, Mai 1). Rotaviren-Gastroenteritis. RKI-Ratgeber. https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Rotaviren.html
Robert Koch-Institut. (2013, September 30). Ständige Impfkommission (STIKO) am RKI: FAQs zu Rotavirus-Impfung und Stillen. Infektionsschutz. https://www.rki.de/DE/Content/Infekt/EpidBull/Archiv/2013/39/Art_03.html
Robert Koch-Institut. (2014, Juli 2). Rotavirus. EM-Aufnahmen. https://www.rki.de/DE/Content/Infekt/NRZ/EM/Aufnahmen/EM_Tab_Rotavirus.html?nn=2463800
Robert Koch-Institut. (2015, Mai 12). Mitteilung der Ständigen Impfkommission (STIKO) zur Rotavirus-Impfung. Ständige Impfkommission. https://www.rki.de/DE/Content/Kommissionen/STIKO/Empfehlungen/STIKO_Weitere/STIKO_RotavirusImpfung.html
Robert Koch-Institut. (2024a, Februar 7). Schutzimpfung gegen Rotaviren: Häufig gestellte Fragen und Antworten. Impfungen A - Z. https://www.rki.de/SharedDocs/FAQ/Impfen/Rota/FAQ-Liste_Rotavirus_Impfen.html
Robert Koch-Institut. (2024b, Februar 9). SurvStat@RKI 2.0. https://survstat.rki.de/. https://survstat.rki.de/
Rosillon, D., Buyse, H., Friedland, L. R., Ng, S.-P., Velázquez, F. R., & Breuer, T. (2015). Risk of Intussusception After Rotavirus Vaccination: Meta-analysis of Postlicensure Studies. The Pediatric Infectious Disease Journal, 34(7), 763–768. https://doi.org/10.1097/INF.0000000000000715
Ruiz-Palacios, G. M., Pérez-Schael, I., Velázquez, F. R., Abate, H., Breuer, T., Clemens, S. C., Cheuvart, B., Espinoza, F., Gillard, P., Innis, B. L., Cervantes, Y., Linhares, A. C., López, P., Macías-Parra, M., Ortega-Barría, E., Richardson, V., Rivera-Medina, D. M., Rivera, L., Salinas, B., … O’Ryan, M. (2006). Safety and Efficacy of an Attenuated Vaccine against Severe Rotavirus Gastroenteritis. New England Journal of Medicine, 354(1), 11–22. https://doi.org/10.1056/NEJMoa052434
Santé Publique France. (2023a, April 20). Gastroentérite à rotavirus du nourrisson: Les 5 bonnes raisons de se faire vacciner. Déterminants de santé. https://www.santepubliquefrance.fr/import/gastroenterite-a-rotavirus-du-nourrisson-les-5-bonnes-raisons-de-se-faire-vacciner
Santé Publique France. (2023b, September 26). Gastro-entérite à rotavirus. vaccination-info-service.fr. https://vaccination-info-service.fr/Les-maladies-et-leurs-vaccins/Gastro-enterite-a-rotavirus
Schwartzberg, L. S., & Navari, R. M. (2018). Safety of Polysorbate 80 in the Oncology Setting. Advances in Therapy, 35(6), 754–767. https://doi.org/10.1007/s12325-018-0707-z
Shai, S., Perez-Becker, R., Von König, C.-H. W., Von Kries, R., Heininger, U., Forster, J., Huppertz, H.-I., Roos, R., Göbel, U., & Niehues, T. (2013). Rotavirus Disease in Germany—A Prospective Survey of Very Severe Cases. Pediatric Infectious Disease Journal, 32(2), e62–e67. https://doi.org/10.1097/INF.0b013e31826f602b
Simwaka, J. C., Mpabalwani, E. M., Seheri, M., Peenze, I., Monze, M., Matapo, B., Parashar, U. D., Mufunda, J., Mphahlele, J. M., Tate, J. E., & Mwenda, J. M. (2018). Diversity of rotavirus strains circulating in children under five years of age who presented with acute gastroenteritis before and after rotavirus vaccine introduction, University Teaching Hospital, Lusaka, Zambia, 2008-2015. Vaccine, 36(47), 7243–7247. https://doi.org/10.1016/j.vaccine.2018.03.035
Troeger, C., Khalil, I. A., Rao, P. C., Cao, S., Blacker, B. F., Ahmed, T., Armah, G., Bines, J. E., Brewer, T. G., Colombara, D. V., Kang, G., Kirkpatrick, B. D., Kirkwood, C. D., Mwenda, J. M., Parashar, U. D., Petri, W. A., Riddle, M. S., Steele, A. D., Thompson, R. L., … Reiner, R. C. (2018). Rotavirus Vaccination and the Global Burden of Rotavirus Diarrhea Among Children Younger Than 5 Years. JAMA Pediatrics, 172(10), 958–965. https://doi.org/10.1001/jamapediatrics.2018.1960
van Dongen, J. A. P., Rouers, E. D. M., Bonten, M. J. M., & Bruijning-Verhagen, P. C. J. (2021). Evaluation of non-specific effects of human rotavirus vaccination in medical risk infants. Vaccine, 39(41), 6151–6156. https://doi.org/10.1016/j.vaccine.2021.08.067
Varma, R. K., Kaushal, R., Junnarkar, A. Y., Thomas, G. P., Naidu, M. U., Singh, P. P., Tripathi, R. M., & Shridhar, D. R. (1985). Polysorbate 80: A pharmacological study. Arzneimittel-Forschung, 35(5), 804–808.
Vega, R. M., & Avva, U. (2024). Pediatric Dehydration. In StatPearls. StatPearls Publishing. http://www.ncbi.nlm.nih.gov/books/NBK436022/
Ward, R. L., Bernstein, D. I., Young, E. C., Sherwood, J. R., Knowlton, D. R., & Schiff, G. M. (1986). Human rotavirus studies in volunteers: Determination of infectious dose and serological response to infection. The Journal of Infectious Diseases, 154(5), 871–880. https://doi.org/10.1093/infdis/154.5.871
Wilking, H., Höhle, M., Velasco, E., Suckau, M., & Eckmanns, T. (2012). Ecological analysis of social risk factors for Rotavirus infections in Berlin, Germany, 2007-2009. International Journal of Health Geographics, 11, 37. https://doi.org/10.1186/1476-072X-11-37
Willame, C., Cheuvart, B., Aris, E., Vetter, V., & Cohet, C. (2021). Association between rotavirus gastroenteritis and intussusception: Suggested evidence from a retrospective study in claims databases in the United States. Human Vaccines & Immunotherapeutics, 17(1), 269–277. https://doi.org/10.1080/21645515.2020.1770514
World Health Organization. (2018, September 5). Rotavirus. Vaccine-Preventable Diseases Surveillance Standards. https://cdn.who.int/media/docs/default-source/immunization/vpd_surveillance/vpd-surveillance-standards-publication/who-surveillancevaccinepreventable-19-rotavirus-r2.pdf?sfvrsn=2c43bf06_10&download=true
World Health Organization. (2021, Juli 16). Summary of the WHO position paper on Rotavirus vaccines WHO position paper- 16 July 2021. Cdn.Who.Int. https://cdn.who.int/media/docs/default-source/immunization/position_paper_documents/rotavirus/rotavirus-summary-23july-2021.pdf?sfvrsn=8c06e9d8_7#
Yih, W. K., Lieu, T. A., Kulldorff, M., Martin, D., McMahill-Walraven, C. N., Platt, R., Selvam, N., Selvan, M., Lee, G. M., & Nguyen, M. (2014). Intussusception risk after rotavirus vaccination in U.S. infants. The New England Journal of Medicine, 370(6), 503–512. https://doi.org/10.1056/NEJMoa1303164
Zhou, R., Xu, J. L., Wu, D., & Tang, J. L. (2015). Analysis of prognostic factors for infantile rotavirus infection. Genetics and Molecular Research: GMR, 14(1), 790–796. https://doi.org/10.4238/2015.February.2.3
Stand: 16. Feb. 2024
Nächste Aktualisierung: 16. Feb. 2025